本文讨论了TDLN中肿瘤驱动的分子、结构和免疫改变以及它们对淋巴结转移和免疫的影响,并强调了TDLN不是肿瘤发展的罪魁祸首,而是治疗干预的重要机会。
2021年9月3日,纽约大学格罗斯曼医学院的Amanda W. Lund在《Science immunology》上发表了一篇名为“Tumor-draining lymph nodes: At the crossroads of metastasis and immunity”的综述。目前对肿瘤参与淋巴运输和调节肿瘤引流淋巴结的早期机制的理解,以及这些变化对转移和免疫的意义。

非淋巴组织的实体瘤早期浸润淋巴系统是癌症的临床特征,常预示预后不良。然而,大量的淋巴结清扫实验和肿瘤血液转移研究对淋巴结转移对远处扩散的意义提出质疑。尽管如此,对肿瘤引流淋巴结(TDLN)免疫学作用的新认识重新引起了人们对其基础生物学、在转移进展中的作用以及抗肿瘤免疫和患者预后的兴趣。
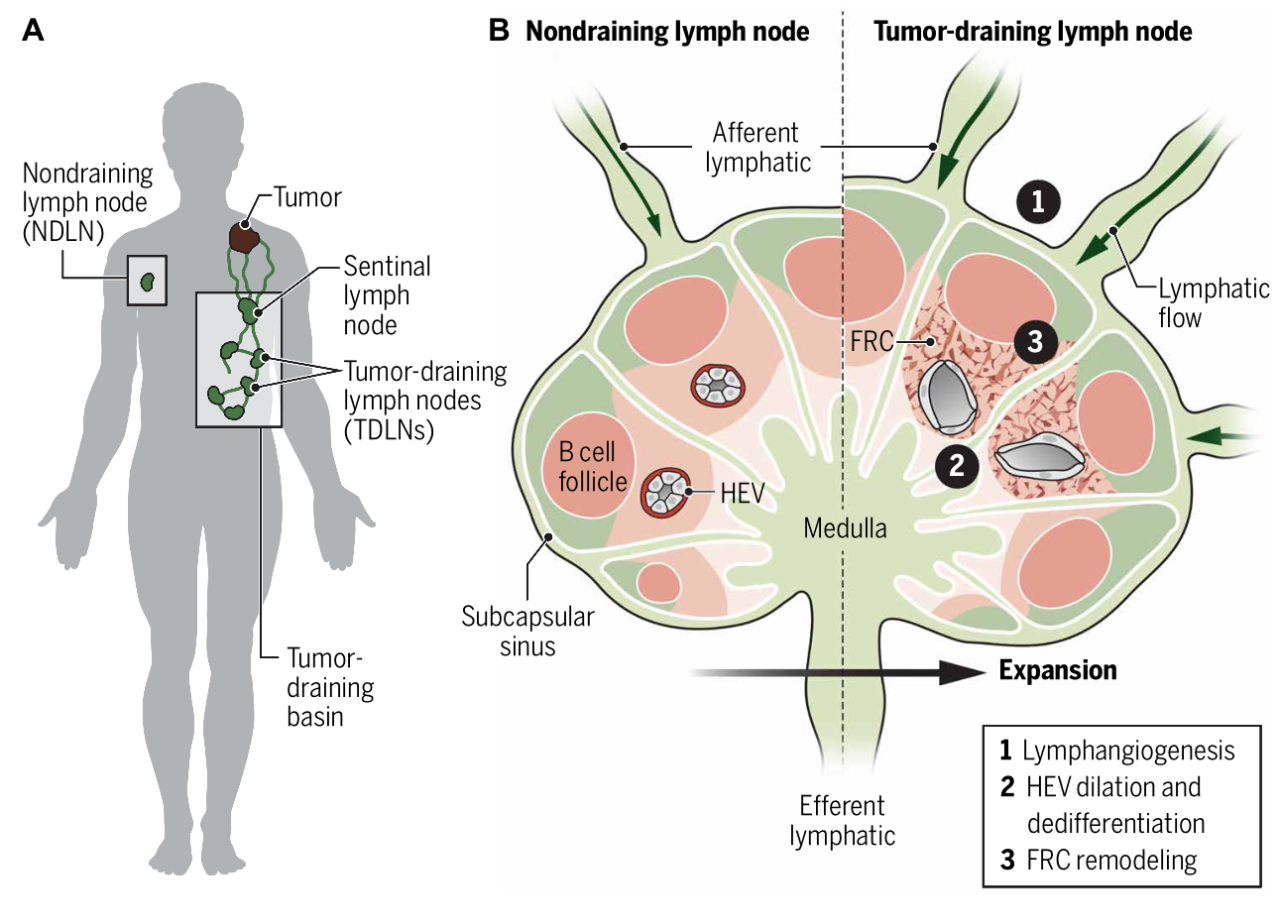
外周实体瘤通常会在功能上联合区域淋巴管及其引流淋巴结 (LN) 以促进转移。如图1A所示,前哨淋巴结(SLN)被定义为第一个引流原发肿瘤的淋巴结;通过连接肿瘤相关的淋巴血管系统,在肿瘤引流池内的非SLN (NSLN)和远处非引流淋巴结(NDLN)中转移传播的可能性也很高。尽管SLN中肿瘤细胞的存在是许多肿瘤类型的负面预后因素,但对于立即去除可能藏有隐匿性微观疾病的肿瘤引流 LN (TDLN)是否具有治疗益处仍存在争议。
LN 的物理结构作为功能性支架,定位白细胞以实现快速免疫监视和外周耐受;当遇到抗原后,淋巴细胞迅速增殖、分化,通过出管淋巴管退出淋巴结,最终在各种非淋巴组织中发挥效应功能。因此,LN间质的精确协调有助于外周组织攻击后的适应性免疫反应,肿瘤转移至LN,会破坏其结构,导致白细胞定位和功能改变,进而可能有助于肿瘤的局部转移潜能。如图1B所示,肿瘤诱导LN重塑主要有以下主要的三个过程:1)淋巴窦扩张和淋巴管内皮细胞(LECs)增生;2)高内皮小静脉(HEVs)扩张和去分化;3)成纤维细胞网状细胞(FRC)内衬的皮质胶原管道系统重塑和纤维化。
处于稳态时,LN表现为抗肿瘤转移表型;而当LN受到皮下肿瘤或皮下给药的肿瘤条件培养基的调节时,LN会转变为促进肿瘤生长的促肿瘤转移表型。以上表明免疫依赖和免疫独立机制可能共同控制淋巴结转移和全身免疫监测,但对启动促肿瘤转移性LN 重塑的特定因素目前未知。这里假设肿瘤引流细胞外囊泡与其他肿瘤衍生因子可能一起作为早期淋巴传播信号,破坏区域性TDLN 中的宿主免疫,同时也有助于塑造转移前生态位。
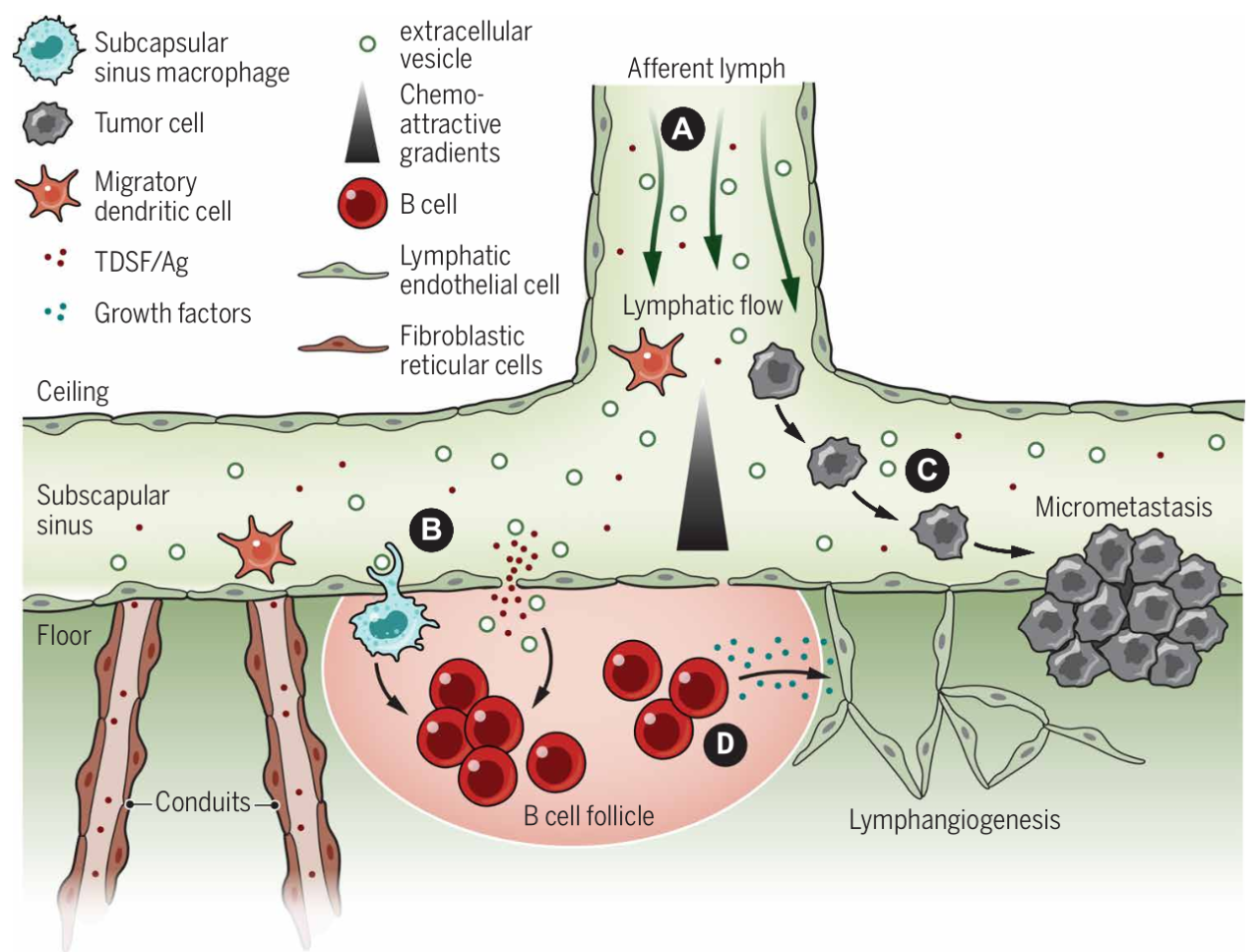
淋巴管内皮细胞 (LEC) 衬里的囊下窦 (SCS)作为肿瘤引流淋巴、白细胞和肿瘤细胞到达 TDLN 的第一个部位,可以作为转移性播种、存活和生长的显微解剖位置。如图2所示,SCS 由专门的LEC和交叉的SCS巨噬细胞排列组成,这些细胞率先于传入淋巴的肿瘤衍生因子接触;其中TDLN中 SCS 巨噬细胞屏障的状态可能与预测区域的转移潜力相关,且会被体液免疫的变化所影响。SCS 不仅是转移性接种位点,而且还调节迁移性树突细胞 (migDC)运输,从而调节抗原呈递,肿瘤引流SCS的肿瘤诱导趋化因子可能会影响T细胞对肿瘤相关抗原的启动类型,从而导致到达TDLN的DC可能直接促成TDLN中SCS的转移潜能。综上,LN 内驱动局部淋巴管生成的生长因子的产生不仅可能改变液体和细胞运输,而且还重组指导DC迁移、抗原呈递和肿瘤细胞接种的指导线索,即 SCS代表了一个动态生态位,对来自外周的免疫信号进行分隔,可以影响局部转移病变的建立和进展。
以上描述和相关的临床研究表明肿瘤引流和转移性 LN 作为肿瘤免疫监视的障碍和潜在的免疫治疗靶点,目前已知在TDLN中出现的功能失调免疫反应现象包括:1)抗原呈递功能障碍与T细胞耐受;2)T regs细胞积累与局部免疫抑制;3) B细胞促进免疫逃逸。
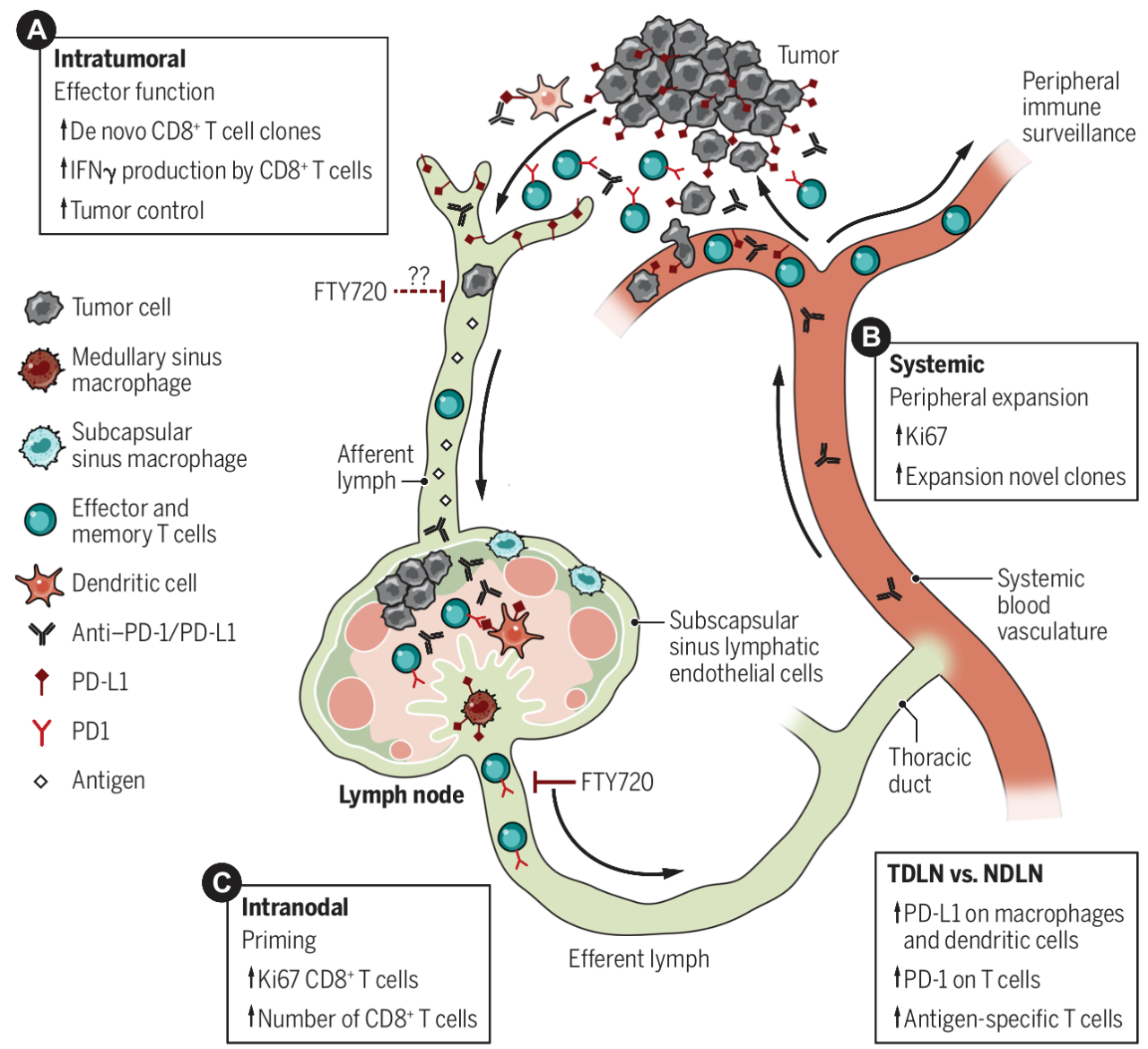
随着免疫疗法,如免疫检查点阻断 (ICB)的成功,以及对 TDLN 完整的新辅助疗法兴趣的日益浓厚,对TDLN 结构和功能的理解可能会为患者的治疗提供信息,并突出免疫重振的新机制。如图3所示,描述了如何将 TDLN 作为免疫治疗反应的重要组成部分;传统研究认为 ICB 通过直接重新激活肿瘤微环境中预先存在但已耗尽的 CD8 + T 细胞来发挥作用,但实际上ICB系统性地激活 T 细胞,从而扩大了肿瘤微环境之外的抗肿瘤免疫反应的范围;这表明ICB活性存在于肿瘤本身之外,并代表这外周激活和新出现的T细胞克隆的扩增可能是对治疗的强大反应所必需的,意味着TDLN在产生这些对ICB的新生反应中发挥了关键作用,并提高了通过改变给药途径和LN靶向工程来提高临床疗效的可能性。
综上所述,本文将TDLN 呈现为区域肿瘤微环境中的一个动态区室,它根据肿瘤发展进行重塑,并直接促进系统性宿主抗肿瘤免疫的逐步破坏,促进转移扩散;但对TDLN 中结构和功能之间的串扰的综合理解将会为转移和免疫之间的关系提供重要的见解。因此,TDLN 不是肿瘤发展的罪魁祸首,而是治疗干预的重要机会——(重新)激活抗肿瘤免疫和预防区域和全身转移,以及指导风险评估和治疗的生物标志物的丰富来源临床护理。
教授介绍

Amanda W.Lund,现任纽约大学格罗斯曼医学院细胞、发育和癌症生物学副教授。2005年毕业于伦斯勒理工学院,获得学士学位,3年后取得硕士学位;2009年开始攻读塞勒理工学院博士,并在洛桑联邦理工学院,淋巴和癌症生物工程实验室完成博士后研究。其研究方向为应用新工具跟踪和量化体内淋巴生物学,包括三维和高内容成像、原位光转换、散装和单细胞转录学以及细胞特异性蛋白造影学策略;通过阐明淋巴血管介质免疫控制的新机制,努力实现利用淋巴血管来调整免疫功能、增强癌症免疫治疗的目标。
参考文献
1、Bois H, Heim TA,. Lund AW.Tumor-draining lymph nodes: At the crossroads of metastasis and immunity. ScienceImmunology. 2021 Sep 3;

原文链接:http://www.xxwk.net/archives/2651






