Cancer Cell | PD-1/PD-L1免疫检查点抑制肿瘤引流淋巴结中的T细胞免疫 近年来,靶向PD-1/PD-L1免疫检查点的药物已经彻底改变了多种肿瘤类型的治疗困境,包括非小细胞肺癌、肾癌和黑色素瘤,在肿瘤治疗领域取得了巨大成功,部分患者产生了持久的免疫应答。然而,仍然有多数患者或肿瘤类型对这些免疫检查点阻断(ICB)药物没有反应,或只是短暂反应。 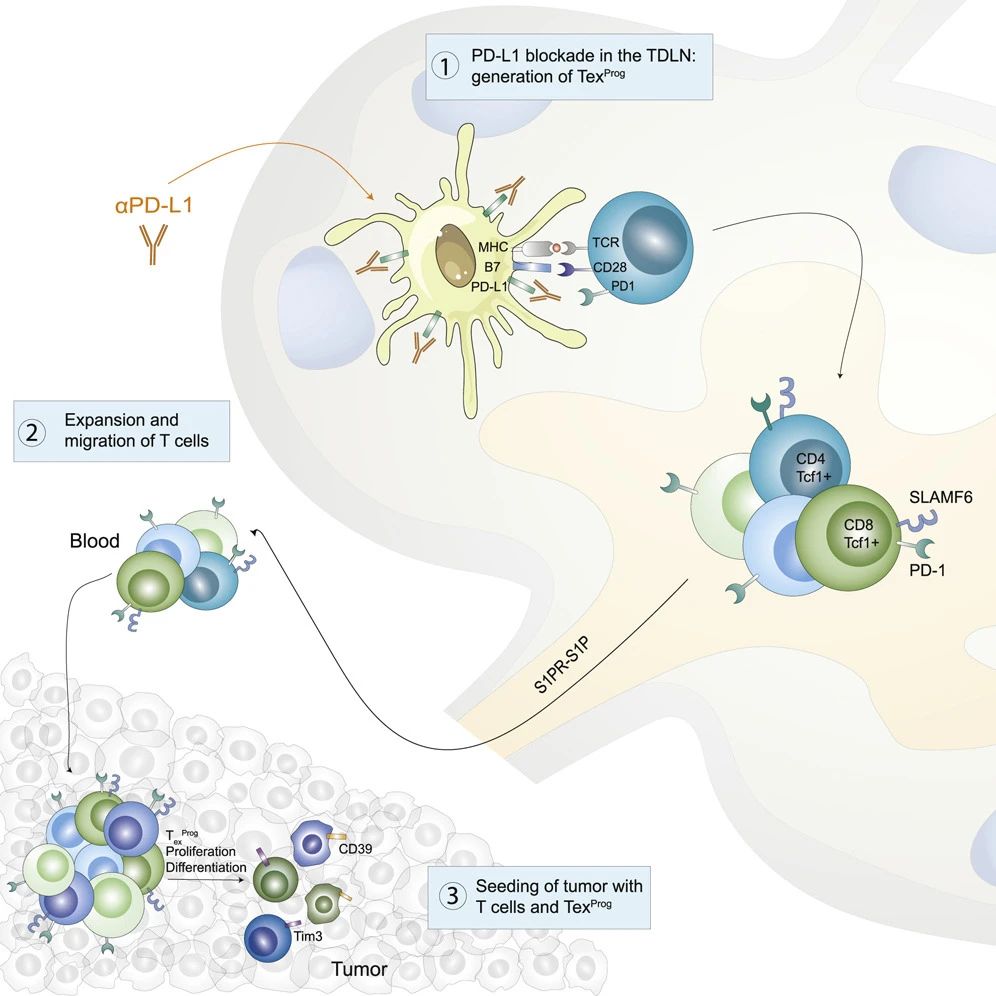 Cancer Cell (2020) 通常认为PD-1/PD-L1免疫检查点阻断抗体主要作用于肿瘤微环境(TME),通过激活耗竭的T细胞从而恢复机体自身的抗肿瘤免疫功能。但最近的几项研究发现,除了肿瘤细胞外,一些髓系细胞也可以表达PD-L1,如巨噬细胞和常规树突状细胞(cDC)。有鉴于此,荷兰伊拉斯姆斯大学的Joachim G. Aerts等研究人员,研究发现PD-1/PD-L1检查点可以抑制肿瘤引流淋巴结中的T细胞免疫。 本文要点 (1)研究人员在表达OVA的AE17小鼠间皮细胞肿瘤模型中发现,肿瘤引流淋巴结(TDLNs)中富含肿瘤特异性PD-1+ T细胞,这些细胞与表达PD-L1+的 cDC紧密相关。
Cancer Cell (2020) 通常认为PD-1/PD-L1免疫检查点阻断抗体主要作用于肿瘤微环境(TME),通过激活耗竭的T细胞从而恢复机体自身的抗肿瘤免疫功能。但最近的几项研究发现,除了肿瘤细胞外,一些髓系细胞也可以表达PD-L1,如巨噬细胞和常规树突状细胞(cDC)。有鉴于此,荷兰伊拉斯姆斯大学的Joachim G. Aerts等研究人员,研究发现PD-1/PD-L1检查点可以抑制肿瘤引流淋巴结中的T细胞免疫。 本文要点 (1)研究人员在表达OVA的AE17小鼠间皮细胞肿瘤模型中发现,肿瘤引流淋巴结(TDLNs)中富含肿瘤特异性PD-1+ T细胞,这些细胞与表达PD-L1+的 cDC紧密相关。  图1 TDLNs中富含PD1+的T细胞 Cancer Cell (2020) (2)利用CD45.1+ OTI/II T细胞回输给CD45.2+的小鼠,研究人员发现CD45.1+细胞最初归巢于TDLNs在内的次级淋巴器官,随后通过血液进入肿瘤组织。通过归巢于TDLNs,CD45.1+T细胞上调PD-1并增殖。
图1 TDLNs中富含PD1+的T细胞 Cancer Cell (2020) (2)利用CD45.1+ OTI/II T细胞回输给CD45.2+的小鼠,研究人员发现CD45.1+细胞最初归巢于TDLNs在内的次级淋巴器官,随后通过血液进入肿瘤组织。通过归巢于TDLNs,CD45.1+T细胞上调PD-1并增殖。  图2 T细胞回输实验表明了T细胞的归巢路径 Cancer Cell (2020) (3)研究人员通过控制剂量和给药方式,构建了选择性的将PD-L1抗体靶向肿瘤引流淋巴结的体系,并对AC29间皮瘤和MC38结肠癌进行TDLNs靶向和全身的PD-L1抗体治疗,两种方式都可以降低肿瘤负担(tumor burden)并增加生存率。更为重要的是,研究人员发现了具有干细胞样特性的肿瘤浸润型T细胞(tumor-infiltrating T cells,TILs),称为TEXprog(特征:SLAMF6+)。随后研究者利用FTY720(S1P receptor激动剂,可以阻断T细胞从淋巴器官流出)废除了PD-L1抗体的治疗效果,使得CD4+辅助性T细胞和CD8+ TILs数量减少,而PD-1+的T细胞增多,表明阻断PD-L1能增强肿瘤引流淋巴结对T细胞(包括TEXprog)的启动和激活作用。
图2 T细胞回输实验表明了T细胞的归巢路径 Cancer Cell (2020) (3)研究人员通过控制剂量和给药方式,构建了选择性的将PD-L1抗体靶向肿瘤引流淋巴结的体系,并对AC29间皮瘤和MC38结肠癌进行TDLNs靶向和全身的PD-L1抗体治疗,两种方式都可以降低肿瘤负担(tumor burden)并增加生存率。更为重要的是,研究人员发现了具有干细胞样特性的肿瘤浸润型T细胞(tumor-infiltrating T cells,TILs),称为TEXprog(特征:SLAMF6+)。随后研究者利用FTY720(S1P receptor激动剂,可以阻断T细胞从淋巴器官流出)废除了PD-L1抗体的治疗效果,使得CD4+辅助性T细胞和CD8+ TILs数量减少,而PD-1+的T细胞增多,表明阻断PD-L1能增强肿瘤引流淋巴结对T细胞(包括TEXprog)的启动和激活作用。  图3 靶向TDLNs的PD-L1抗体治疗增强了T细胞抗肿瘤免疫能力 Cancer Cell (2020) 另外,阻断PD-L1可以在肿瘤部位播种祖细胞耗竭的T细胞(progenitor-exausted T cells),从而增强T细胞抗肿瘤免疫。 (4)此外,研究人员在临床非转移性黑色素瘤患者中发现,TDLNs中存在大量PD-1/PD-L1相互作用,而其对应的原发肿瘤中PD-1/PD-L1相互作用与较早的疾病复发相关。
图3 靶向TDLNs的PD-L1抗体治疗增强了T细胞抗肿瘤免疫能力 Cancer Cell (2020) 另外,阻断PD-L1可以在肿瘤部位播种祖细胞耗竭的T细胞(progenitor-exausted T cells),从而增强T细胞抗肿瘤免疫。 (4)此外,研究人员在临床非转移性黑色素瘤患者中发现,TDLNs中存在大量PD-1/PD-L1相互作用,而其对应的原发肿瘤中PD-1/PD-L1相互作用与较早的疾病复发相关。  图4 II期黑色素瘤患者TDLNs中PD-1/PD-L1的相互作用 Cancer Cell (2020) 这项研究揭示了TDLNs中PD-L1的表达在控制全身抗肿瘤免疫中的关键作用,并更新了当前的PD-1/PD-L1检查点免疫治疗的传统认识,有望为生物标志物筛选和联合免疫疗法提供新的策略和指导。本文于2020年11月9日发表在Cancer cell 杂志上,影响因子26.601。本文第一作者为来自荷兰鹿特丹伊拉斯姆斯医学中心Floris Dammeijer教授。 参考文献: Floris Dammeijer, et al. The PD-1/PD-L1-Checkpoint Restrains T cell Immunity in Tumor-Draining Lymph Nodes. Cancer Cell, 2020. DOI:10.1016/j.ccell.2020.09.001 https://www.cell.com/cancer-cell/fulltext/S1535-6108(20)30432-3 版权声明:本文所有图片表格均来自《Cancer Cell》杂志 王雪 李群英 浙大二院超声科科研组 翻译整理
图4 II期黑色素瘤患者TDLNs中PD-1/PD-L1的相互作用 Cancer Cell (2020) 这项研究揭示了TDLNs中PD-L1的表达在控制全身抗肿瘤免疫中的关键作用,并更新了当前的PD-1/PD-L1检查点免疫治疗的传统认识,有望为生物标志物筛选和联合免疫疗法提供新的策略和指导。本文于2020年11月9日发表在Cancer cell 杂志上,影响因子26.601。本文第一作者为来自荷兰鹿特丹伊拉斯姆斯医学中心Floris Dammeijer教授。 参考文献: Floris Dammeijer, et al. The PD-1/PD-L1-Checkpoint Restrains T cell Immunity in Tumor-Draining Lymph Nodes. Cancer Cell, 2020. DOI:10.1016/j.ccell.2020.09.001 https://www.cell.com/cancer-cell/fulltext/S1535-6108(20)30432-3 版权声明:本文所有图片表格均来自《Cancer Cell》杂志 王雪 李群英 浙大二院超声科科研组 翻译整理
林涛 编辑
原文链接:http://www.xxwk.net/archives/3089






