一、简介
根据全球癌症观察站的数据,食道癌 (EC) 目前是全球第八大常见癌症,也是第六大常见癌症死因(https://gco.iarc.fr/,2021年 12 月 17 日访问)。2020年确诊病例约60万例,死亡人数超过54万。不同国家的发病率和死亡率差异很大[ 1 ]。直到最近,手术和放化疗的组合一直是局部环境中 EC 的主要治疗方法。最近的 CheckMate 577 试验表明,在新辅助放化疗后手术 EC 的辅助环境中,接受免疫检查点抑制剂 nivolumab 治疗的患者的无病生存率有所提高 [ 2]。在转移性环境中,化疗和免疫检查点抑制剂是主要的可用治疗方法 [ 3 , 4 ]。诊断后,临床和放射学分期对于向患者提出最佳治疗策略至关重要。欧洲指南推荐了几种成像技术,包括计算机断层扫描 (CT)、正电子发射断层扫描 (PET)/CT、内窥镜超声 (EUS) 以及食管胃十二指肠镜检查 [ 5 , 6 ]。Bosset 等人提出了术前 CT 分类。(cTNM) [ 7 ]。TNM 分期系统由美国癌症联合委员会 (AJCC) 和国际抗癌联盟 (UICC) 提供,用于疾病的病理肿瘤分类 [ 8]。与其他方式相反,磁共振成像 (MRI) 是一种非辐射和非侵入性技术。它还提供出色的软组织对比度。由于其相对较低的可用性和技术限制,它目前不是用于 EC 管理的常规检查。尽管如此,它似乎是一种很有前途的技术,可用于肿瘤分期、放化疗前靶区的勾画、治疗反应和复发预测。多年来 MRI 模式的改进,以及更多序列选择的发展,有助于提高 EC 的 MRI 性能。这篇叙述性综述的目的是总结目前关于 MRI 在 EC 管理中作用的证据。
2. 食管的 MRI 模式
2.1。食管超时MRI的主要技术发展
首先使用心电图 (ECG) 门控 MRI 在 78 名患者中评估矢状视图中正常食道的测量和描述。2004 年,Manabe 等人。比较了 20 名健康志愿者的 T1 加权超快梯度回波 (TFE) MRI 和 T1 加权快场回波 (FFE) MRI,旨在描绘动态条件下的食管通道 [ 9 ]:快场回波图像在信噪比和整体质量方面[ 9 ]。2006 年使用外表面线圈和带有 T2 加权快速自旋回波 (FSE) 序列的心脏门控进一步提高了食管 MRI 质量的信号和采集速度 [ 10]。后来,使用具有类似方案的高场 MRI 进行的离体研究有助于精确定义后纵隔的 MRI 解剖结构 [ 11 ]。同样,在一项针对 33 例手术患者的研究中,术前高分辨率 T2 加权 FSE 序列提供了详细的图像,并且与组织学结果的比较表明,食管壁浸润程度与病理 T 分期之间存在良好的相关性 [ 12 ]。此外,7.0-T 的超高分辨率 T2 加权 MRI 提供了食管壁的清晰定义和 T 分期的出色准确性 [ 13 ]。2017 年,治疗前运动触发 MRI 被用于改善对食管周围组织的描述 [ 14 ]。食管的动态 MRI,使用各种造影剂的口服给药,已被提议用于评估矢状图像上的食管蠕动 [ 15 ]。与钡混合的钆喷酸葡胺 [ 16 ]、柠檬酸铁铵-纤维素糊 [ 17 ]、掺有钆螯合物的酪乳 [ 15 ]、与马铃薯淀粉混合的浓缩菠萝汁 [ 18 ] 均经过测试,结果令人满意,可以描述在矢状面平均超过 16 厘米,并定义食管通过时间的正常值 [ 19 , 20]。值得注意的是,后一种腔内药剂提供的图像质量与使用顺磁性造影剂获得的图像质量相似。
2.2. 我们如何在我们的中心做到这一点
在我们的中心,我们在静脉注射钆螯合物之前和之后获得冠状和轴向平面的 T1 加权图像;然后在轴向和冠状平面上的 T2 加权单发脊柱回波序列,以及在平行于食管胃交界处的斜平面获得稳态序列的动态运动学采集。在动态采集阶段,要求患者通过吸管吞下水。这重复了几次,以便可视化食道收缩。序列参数列于表1. 矢状斜运动序列的正确放置对于可视化食管和食管胃交界处至关重要。事实上,采集框中心脏的存在会导致运动伪影。在 T2 加权图像和稳态电影序列上分析形态标志。表 1. 我们在我们的中心是如何做到的:1.5 T 下的不同磁共振成像序列参数(Siemens Aera,vb20a)。
我们在图 1和图 2中展示了在两个不同患者中用于 EC 初始分期的不同方式的结果。
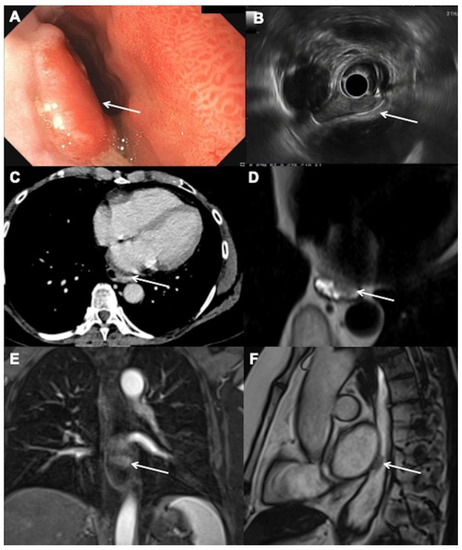
图 1. 一名 66 岁女性 T2N0M0 食管腺癌的初始分期:( A ) 内镜下可见食管左后侧 Barrett 食管出现隆起的肿瘤病变,距牙弓 34 cm(箭头)。( B ) 超声内镜显示低回声、局限的肿瘤病灶与固有肌层紧密接触,无区域淋巴结(箭头)。( C ) 静脉注射碘化造影剂后 70 s 的增强计算机断层扫描图像,在轴向平面上没有口服收缩材料,显示食管不规则(箭头),但没有明确的病变。( D) 轴向 T2 加权单次磁共振 (MR) 图像。口服水后显示低信号不规则的前病变(箭头)。( E ) 冠状对比增强 T1 加权图像证实了显示早期对比吸收的病变(箭头)。( F ) 矢状稳态 MR 图像确认低信号病变(箭头)并允许精确查看其位置。
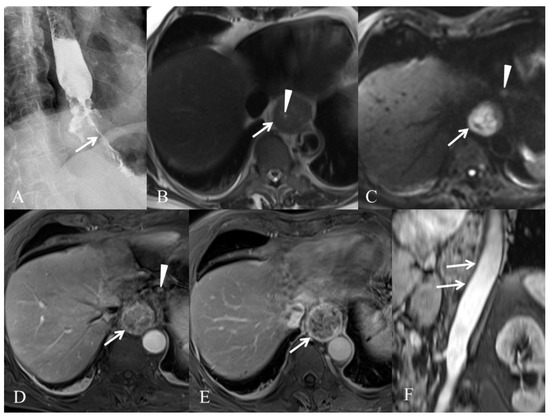
图 2. 一名 77 岁男性 T3N1M0 食管腺癌的初始分期。( A ) 食管造影显示食管下三分之一的食管肿瘤导致明显的管腔狭窄(箭头)。( B ) 轴位 T2 加权 HASTE MR 图像显示食管肿瘤(箭头)伴管腔狭窄(箭头)。( C ) 高 b 值 (b = 800 s/mm 2 ) 轴向平面的弥散加权 MR 图像显示弥散受限 (箭头) 与恶性食管肿瘤一致。存在额外的高信号淋巴结(箭头)。( D) 静脉注射含钆造影剂(钆酸葡甲胺,Dotarem®,Guerbet,Villepinte,France)后 30 秒获得的轴向平面 T1 加权 VIBE 图像显示异质性食管肿瘤(箭头)和增强淋巴结(箭头) . ( E ) 静脉注射含钆造影剂(钆酸葡甲胺,Dotarem®,Guerbet)后 60 秒获得的轴向平面 T1 加权 VIBE 图像显示肿瘤轮廓清晰,没有扩散到外膜外(箭头)。( F ) 斜平面 MR 血管造影图像显示食管肿瘤和主动脉之间的完整界面(箭头)。
3. MRI 和食管癌 (EC) 诊断和分期
3.1。初始肿瘤 (T) 分期
EC 的主要挑战之一是评估局部分期以选择最佳治疗方法。对于低分期 EC,前期手术或新辅助治疗之间的最佳治疗仍不清楚,并将受到稳健分期的影响。肿瘤 (T) 分期通常使用 EUS 进行。2008 年,一项包括 49 项研究在内的术前 EC 荟萃分析发现,不同 T 分期分化的汇总敏感性为 81.6% 至 92.4%,在晚期 (T4) 疾病中表现更好[ 21 ]。T1 和 T4 癌症的汇总特异性分别为 99.4% 和 97.4% [ 21 ]。在最近一项关于术前 ESCC 的荟萃分析中,EUS 对 T 分期的总体准确率为 79%(95% CI:88-94)[ 19 ]。EUS 在评估 T 分期方面优于 CT,因为 CT 无法区分不同的组织学层 [ 20 , 22 , 23 ]。在通过排除高 T 期肿瘤来确定可切除性时,CT 是可靠的 [24、25 ] 。 _ 18 F-氟脱氧葡萄糖 ( 18 F-FDG) PET/CT 由于其空间分辨率低,对 T 分期的作用有限,主要用于远处转移灶的诊断 [ 24 , 26 ]。虽然 EUS 的局部和区域分期准确性高于 CT 和 PET [ 27 ],但 EUS 具有侵入性和操作者依赖性,有时会受到肿瘤狭窄的限制 [ 28 ]。考虑到这一点,MRI 似乎是评估 EC 中 T 分期的有前途的工具。各种体外研究发现,MRI 可以清楚地描述食管壁的不同层次,对评估壁侵犯具有很高的诊断准确性[ 29 , 30 ]。在高分辨率 T2 加权和弥散加权 MRI (DWI) [ 31 , 32 , 33 ] 以及体内设置 [ 12 , 13 ] 的离体环境中发现了类似的结果。多年来 MRI 模式的改进有助于提高 MRI 诊断和 EC 分期的性能 [ 34 , 35]。然而,不同研究中使用的 MRI 模式和序列的异质性限制了当前可用结果的普遍性。在 39 名患者中评估的 T2 加权 FSE 技术在区分 T2 和 T3 疾病方面显示出很高的准确性,但有过度分期 T1 肿瘤的趋势 [ 12 ]。一项评估两种不同体积插值屏气序列 (VIBE) 对 EC T 分期影响的试验发现,对比增强的自由呼吸径向 VIBE 优于屏气笛卡尔 VIBE,尤其是对于 T1 和 T2 阶段 EC [ 36 ]。在 30 名胸部 EC 患者和 10 名健康志愿者中评估了 MR 食管造影和吞水 [ 37]。与传统 MRI 相比,它在评估肿瘤长度和精确定位方面显示出更好的结果,但对 T 分期的准确性较低 [ 38 ]。T2* 加权成像在评估 ESCC 患者的 T 分期方面具有良好的准确性,除了 T0 和 T1 期肿瘤之间的分化 [ 39 ]。在 Wu 等人的一项研究中,60 名 ESCC 患者的 T2 加权 MRI、对比增强 T1 加权和 DWI 评估的大体肿瘤体积 (GTV) 与 T 期和淋巴结转移的存在相关 [ 40 ]。他们还报告说,在对比增强 T1 加权成像中诊断出的 GTV 可以更好地预测 T 分期 [ 40]。此外,一项工作表明,动态对比增强 (DCE)-MRI 的一些药代动力学参数的全肿瘤直方图分析可能能够预测 ESCC 的 T 期 [ 41 ]。此外,同一疗程中的胸部 MR 血管造影提供了有关癌症在血管中的侵袭性、血管异常(包括动脉和静脉状态)的非常有用的信息。最近发表的一项针对 20 项试验的荟萃分析解决了 EC 的 MRI 诊断性能问题,包括精确 T 分期的问题 [ 35 ]。2009 年至 2019 年间发表的 11 项试验解决了 T0 和 T1 或更晚期疾病之间的区分问题,MRI 的综合敏感性为 92%(95% CI:82-96),特异性为 67%(95% CI:51 –81)。新辅助放化疗的管理对这些结果没有显着影响 [ 35]。有 10 项研究评估了 T2 或更低疾病与 T3 或更高疾病之间的差异,MRI 的综合敏感性为 86%(95% CI:76-92),特异性为 86%(95% CI;75-93)。不幸的是,作者没有解决 MRI 对区分 T0 或 T1 肿瘤(适合内镜下低发病率切除)和≥T2 肿瘤(需要放化疗和/或手术切除)的诊断价值的具体问题。总体而言,MRI 对 EC 的 T 分期具有良好的敏感性。尽管现有研究在 MRI 序列、研究设计和 EC 组织学亚型方面存在异质性,但支持术前 EC 中通过 MRI 进行 T 分期的高精度的证据正在增加。MRI 对低 T 分期表现出良好的敏感性,对较高 T 分期表现出良好的敏感性和特异性。在不久的将来,单独使用 MRI 或结合其他方式可能会在常规临床实践中用于 EC 的早期 T 分期。
3.2. 节点 (N) 分期
诊断后,评估淋巴结 (N) 分期的区域分期对于评估预后和选择最佳治疗方法也至关重要。生存不仅与 T 阶段相关,而且还明显受到 N 阶段的影响 [ 42 ]。事实上,淋巴结转移的病理学证据是手术 EC [ 37 , 42 ] 的主要预后因素,在淋巴结受累的情况下,5 年总生存率在 70% 到 92% 之间,而在淋巴结受累的情况下为 18% 到 47%。淋巴结受累 [ 43 , 44]。此外,淋巴结比率,即浸润淋巴结数除以切除淋巴结总数,也是手术患者生存的独立因素 [ 45 ]。目前,EC 中的基线区域淋巴结受累也最好用 EUS 进行评估,其次是 CT 和18 F-FDG-PET/CT [ 24 , 25 , 26 ]。EUS 可以通过细针穿刺 (FNA) 对区域淋巴结(纵隔和腹腔)进行组织学评估。在 2008 年的一项荟萃分析中,EUS 显示 N 分期的综合敏感性为 80%(95% CI:75-84),综合特异性为 70%(95% CI:65-75)[ 46 ]。多项研究表明,EUS-FNA 在 N 分期方面比单独的 EUS 具有更高的准确性 [ 47 , 48]。在 Puli 等人的荟萃分析中,N 分期与 EUS 的汇总敏感性从 84.7(95% CI:82.9-86.4)提高到 FNA [ 21 ] 的 96.7%(95% CI:92.4-98.9)。在 Van Vliet 等人的荟萃分析中,CT 和18 F-FDG-PET/CT 均显示 EC 区域 N 分期的敏感性较低,分别为 50%(95% CI:41-60)和 57%(95 % CI:43–70),分别 [ 46 ]。关于18 F-FDG-PET/CT,这可以部分解释为难以区分与具有高标准摄取值的高度狂热的原发性肿瘤相邻的淋巴结。由于先前描述的当前 N 分期技术的局限性,MRI 也已在此设置中进行了评估。早期研究使用0.35–1.5 T 的常规 MRI 没有快速序列报告的敏感性、特异性和诊断准确性分别为 25–70% 、67–93 %和56–89 % [ 49、50、51、52 ]。最近采用类似方式的研究支持这些发现,并发现相似的敏感性、特异性和准确度分别为 38-62%、68-85% 和 64-77 % [ 53、54]。静脉给药后被巨噬细胞吞噬的超顺磁性氧化铁(SPIO)增强了MRI在检测淋巴结转移中的价值。事实上,由于吞噬细胞数量的减少,转移性淋巴结的 SPIO 摄取显着减少 [ 55 , 56 ]。在 Nishimura 等人对 16 名患者进行的一项研究中,超小型 SPIO 增强 MRI 的结果优于其灵敏度、特异性和准确度分别为 100%、95% 和 96% [ 54 ]。这些结果的局限性在于纳入的患者数量较少,并且评估了阳性和阴性淋巴结组之间的差异,而不是淋巴结阳性与淋巴结阴性患者的差异 [ 54]。后来,一项对 9 名 EC 和术前淋巴结阳性患者的可行性研究表明,超小型 SPIO 增强 MRI 可以识别这些疑似淋巴结转移中的大部分 [ 57 ]。2009 年,一项针对 24 例 EC 患者的研究表明,全身 DWI 与背景体信号抑制并没有导致 N 分期的重大诊断改善 [ 58 ]。2020 年一项针对 76 名患者的研究的最新证据表明,DWI在诊断 ESCC 转移性淋巴结方面的敏感性高于18 F-FDG-PET/CT [ 59]。在 35 名 EC 患者中,ECG 触发的 1.5 T MRI 与涡轮自旋回波 (TSE) 和快速短 tau 反转恢复 (STIR) 脂肪抑制对淋巴结受累的诊断产生了 81% 的敏感性和 98% 的特异性 [ 60 ]。如前所述,在 Wu 等人的研究中,60 名 ESCC 患者的 T2 加权成像、对比增强 T1 加权和 DWI 评估的 GTV 与淋巴结转移的存在有关 [ 40 ]。另一项针对 46 名 EAC 患者的研究发现了类似的结果 [ 61 ]。最近,在 90 名患者的训练队列中开发并在 90 名患者的验证队列中得到证实的具有 9 种 MRI 特征的放射学特征显示出转移性和非转移性淋巴结之间的良好区分 [ 62]。至于 T 分期,一项研究表明,动态对比增强 MRI 的一些药代动力学参数的全肿瘤直方图分析可能能够预测 ESCC 的区域淋巴结转移[ 41 ]。Lee 等人最近发表的荟萃分析也评估了 MRI 对淋巴结评估的性能。[ 35 ]。2007 年至 2019 年间发表的 10 项试验解决了区分 N0 疾病与 N1 和更晚期疾病的问题,MRI 的综合敏感性和特异性分别为 71%(95% CI:60-80)和 72%(95% CI: 64-79) 分别 [ 35 ]。同样,多年来,MRI 模式的改进对其在 EC 中 N 分期的诊断性能产生了积极影响。即使最近的证据也支持 MRI 对 N 分期具有良好的敏感性和特异性,但由于现有不同研究中使用的 MRI 技术的异质性及其小样本量,仍然难以得出确切的结论。
3.3. 转移(M)分期
目前使用 CT 和18 F-FDG-PET/CT 评估 EC 中的远处转移。如前所述,2004 年的一项荟萃分析评估了18 F-FDG-PET/CT 诊断远处转移的性能,发现合并的敏感性和特异性分别为 67%(95% CI:58-76)和 97%(95 % CI:90–100),分别 [ 26 ]。在 Van Vliet 等人 2008 年的荟萃分析中,18 F-远处转移诊断的敏感性和特异性分别为 71%(95% CI:62-79)和 93%(95% CI:89-97)。 FDG-PET/CT,52% (95% CI: 33–71) 和 91% (95% CI: 86–96) 用于 CT [ 46 ]。在一项研究中,重新分期18EC 新辅助治疗后的 F-FDG-PET/CT 导致 8% 的患者诊断为转移,但也有 5% 的患者出现假阳性结果 [ 63 ]。事实上,18 F-FDG-PET/CT 显示出一些可能影响其性能的局限性,例如 FDG 的非特异性摄取,或存在低摄取肿瘤。此外,18 F-FDG-PET/CT 是一种昂贵的辐照技术。由于所有这些原因,18 F-FDG-PET/CT 在 EC 中的使用仅限于 ESCC 的初始检查,这种成像方式很少用于肿瘤的动态监测,CT 是首选检查。关于 MRI 在 EC 初始 M 分期中的作用的数据很少。两项研究评估了全身 MRI 在该环境中的表现,一项专门针对 EC,另一项针对包括 EC 在内的混合性胃肠癌人群 [ 64 , 65 ]。与18 F-FDG-PET/CT 相比,全身 MRI 在检测原发肿瘤和淋巴结转移以及排除全身转移性疾病方面具有相似的准确性 [ 65 ]。在 49 名 EC 患者中,两种成像方式都能够识别出两名患者的远处转移 [ 65 ]。然而,迄今为止,没有足够的数据推荐常规使用全身 MRI 进行 EC 的 M 分期。
3.4. 照射前的目标体积描绘
放射治疗前准确的肿瘤勾画,包括准确的 GTV,对于确保足够的靶区覆盖同时限制对周围处于危险的器官的毒性非常重要。在各种肿瘤部位的放化疗之前,MRI 已经用于肿瘤描绘。目前EC GTV的勾画主要以CT和18 F-FDG-PET/CT联合使用为主。然而,研究表明,CT 评估的肿瘤长度与病理学之间的相关性较弱,CT 经常高估这一测量值 [ 66 , 67 ]。EUS 已被提议用于评估肿瘤的纵向范围,但结果难以在放射治疗计划过程中转化 [ 68]。MRI 出色的软组织对比度也可以极大地帮助提高这种情况下肿瘤描绘的准确性。一项研究评估了 10 名观察者对 6 名 EC 患者的 MRI 与18 F-FDG-PET/CT 的 GTV 描绘[ 69 ]。与自由呼吸期间获得的18 F-FDG-PET/CT相比,屏气 T2 加权和 DWI 上的 GTV 显得更小,主要变化出现在颅尾方向 [ 69 ]。在胃肠道交界处的两个肿瘤中结合 DWI 和 T2 加权 MRI 序列减少了尾侧边界变化的减少 [ 69]。然而,MRI 描绘并没有减少本研究中观察者间的变异性,这可能部分是由于缺乏使用这种成像方式在 EC 中勾画 GTV 的经验。在另一项包括 42 名 ESCC 手术患者的研究中,与 CT 和 T2 加权 MRI 相比,DWI 是更准确的 GTV 测量方式 [ 66 ]。CT 与病理学之间的肿瘤长度差异为 3.6 毫米,而 DWI 与病理学之间的长度差异低至 0.5 毫米 [ 66 ]。最后,用于 EC 的 MRI 引导放射治疗仍在开发中,但似乎是未来的一个有希望的选择。改进的 GTV 勾画、呼吸门控和每日非辐照 MRI 的在线自适应规划相结合,可以在保护邻近正常器官的同时实现更紧密的目标覆盖 [ 70 ]。
4. MRI 评估治疗反应和预测复发
几项研究表明,与前期手术相比,新辅助治疗对局部 EC 患者的总体生存率有所提高 [ 71 , 72 , 73 ]。然而,在新辅助治疗和手术后,约三分之一的 EC 患者表现出完全的病理反应,并且可能不必要地面临食管切除术的风险 [ 73 ]。此外,一些患者对新辅助治疗没有反应,但会暴露于其副作用。总体而言,早期识别对新辅助治疗无反应者和放化疗后精确重新分期以检测残留疾病是双重挑战。既往研究和荟萃分析表明,EUS、CT 和18 F-FDG-PET/CT 并不总是足以检测新辅助治疗后 EC 残留病灶,总体准确度较差 [ 34 , 74 , 75 , 76 ] . 使用各种成像技术评估新辅助治疗后病理完全缓解的荟萃分析发现合并敏感性为 35%(95% CI:16-60)、62%(95% CI:50-73)、1%(95% CI: 0–92) 和 80% (95% CI: 46–95),以及 83% (95% CI: 71–91)、73% (95% CI: 64–81)、99% (95) 的综合特异性CT、 18 F-FDG-PET/CT、EUS 和 MRI 分别为% CI:81-100)和 83%(95% CI:65-93) [ 77]。事实上,三维 CT 体积变化与组织病理学肿瘤反应无关 [ 78 ]。EUS 受限于难以区分残留肿瘤与炎症和纤维化 [ 79 , 80 ]。最后,炎症后非特异性葡萄糖摄取,或低 FDG 摄取癌症的存在限制了18 F-FDG-PET/CT 在治疗反应监测中的作用。DWI 和派生的表观扩散系数 (ADC) 可以帮助评估肿瘤代谢活动,并在各种研究中显示了对 EC 反应预测的有希望的结果 [ 81 , 82 , 83 , 84 , 85 ]。事实上,结果表明基线扩散加权图像和中期扩散加权图像(治疗期间)之间观察到的变化是良好的预后和预测生物标志物。放化疗前两周 ADC 的相对变化似乎最能预测残留癌症的检测,敏感性为 100%,特异性为 75% [ 83]。此外,ADC 的各种 b 值已经在不同的可用研究中进行了评估 [ 86 ]。一项研究提出了使用体素内不相干运动扩散加权图像预测 EC 治疗反应的有希望的结果,该图像可以同时从组织中获得扩散和灌注信息,而无需使用造影剂 [ 87 ]。除了 DWI,动态对比增强 MRI 还可用于预测 EC 对放化疗的反应 [ 88 , 89 ]。最后,在 29 名接受新辅助放化疗的患者中,每周 T2 加权 MRI 能够识别随着时间推移肿瘤消退体积显着减少的体积变化 [ 90]。在最近的一项荟萃分析中,包括对接受放化疗的 EC 患者进行的 7 项研究,DWI 预测治疗早期反应的综合敏感性和特异性分别为 93%(95% CI:77-98%)和 85%(95% CI: 72-73)对于 ΔADC(放化疗前后 ADC 值的差异)和 75%(95% CI:62-84)和 90%(95% CI:67-97)对于 ADC [ 91 ]。即使纳入的研究具有小样本量的异质性,这些结果也表明 DWI 在评估 EC 治疗反应中的作用。正在进行的 SANO-2 试验 (NCT04886635) 目前正在评估新辅助放化疗后使用18 F-FDG-PET/CT 和内镜活检进行主动监测的作用。同样,随机 ESOSTRATE 试验 (NCT02551458) 正在比较主动监测与手术对放化疗后具有完全病理反应的患者的疗效。最后,正在进行的前瞻性研究 PRIDE (NCT03474341) 正在评估一种多模式预测模型,包括 DWI 和动态对比增强 MRI,以预测患者在新辅助放化疗后获得完全病理反应的个体概率并识别早期无反应者 [ 92 ]。
5. 讨论和观点
最近 MRI 技术模式的改进允许更好地评估正常和病理食道的形态。由于小样本研究以及临床环境和 MRI 序列和方式的异质性,EC 的可用数据仍然稀缺。然而,目前用于 EC 管理的技术(CT、18 F-FDG-PET/CT 和 EUS)显示出明显的局限性,这使得 MRI 成为初始分期(T 分期和 N 分期)和评估放化疗反应的有前途的工具. 仍然没有足够的数据来确定 MRI 在检测远处转移和随访中的潜在作用。目前仅在体外研究的食道高场 (7 T) MRI 显示出对食道癌的出色敏感性和特异性。最重要的是,它提供了食管壁组织层的清晰图像,可与超声内镜或病理学相媲美。这种成像方式的临床应用(目前仅限于大脑和关节)用于 EC 的检查可以实现准确的无创肿瘤分期,甚至可以将可能适合内镜切除的浅 T1 病变与具有深黏膜下浸润的 T1 病变或 T2 病变区分开来需要手术切除。此外,其区分纤维化和肿瘤组织的能力使高场 MRI 成为更好地评估肿瘤对新辅助治疗反应的有希望的候选者。
6。结论
在 EC 中,不同诊断方式的组合可能是实现最佳个体分期的方法。在一项针对 19 例可切除 EC 患者的研究中,与 EUS 相比,PET-MRI 证明 T 分期的准确性可接受,尽管没有统计学意义,但在预测 N 分期方面比 EUS 和18 F-FDG-PET/CT 的准确性更高。 93 ]。此外,放射组学和使用 CT 成像的各种基于人工智能的系统最近在各种疾病中显示出有希望的结果,包括 EC 的诊断和监测 [ 94 , 95 , 96]。可以假设 EC 中以放射组学和人工智能为中心的研究可能会考虑来自 MRI 的数据,以获得更高的性能和准确性。
原文链接:http://www.xxwk.net/archives/501





