
食管手术后最严重的并发症是吻合口不愈合。直到最近还没有一致的吻合口瘘定义。一项针对食管切除术后并发症的荟萃分析包括了98篇出版物,并指出其中63%缺乏并发症的定义。2015年,食管并发症共识小组(ECCG)提出了食管切除术后最常见并发症的定义。在这一共识中,吻合口瘘定义为包括食道、吻合口、吻合钉或管胃的全层胃肠道缺陷,不论其表现或鉴别方法如何。并提出了三种类型。
| 吻合口瘘的类型 | 程度和治疗 |
| 1型 | 使用药物治疗或仅通过观察治疗的局部缺损 |
| 2型 | 局部缺损需要干预,但不需要手术治疗 |
| 3型 | 局部缺损需要手术干预 |
管胃坏死是另一种并发症,主要原因是血管损害。
| 管胃坏死类型 | 内镜描述 | 治疗 |
| 1型 | 局灶坏死 | 额外的监测或非手术治疗 |
| 2型 | 局灶坏死 | 不涉及食管改道的外科治疗 |
| 3型 | 广泛坏死 | 管胃切除和改道 |
尽管围手术期管理和外科技术的进步,瘘发生率率仍在10%至21.2%之间。ECCG提出吻合口瘘率的基准数字为11.4%,它来自24个高容量中心的结果。
与其他消化道吻合术相比,食管吻合术由于多种因素而具有风险。用于重建的器官从远处带入胸腔内部或穿过胸腔。血液供应长度被扩展到可能的最大长度。对于胃管,血供依赖于一条动脉(胃网膜右动脉),对于食道则依赖于粘膜下动脉。由于食道不具有浆膜,因此机械因素也起作用。通过这种脆弱的组织的缝合与开裂率高有关。已经描述了使用周围组织(大网膜,胸膜或心包膜)来加强这种脆弱的吻合术。吻合口瘘的风险因素包括肥胖,心力衰竭,冠心病,血管疾病,肾脏疾病和吸烟。
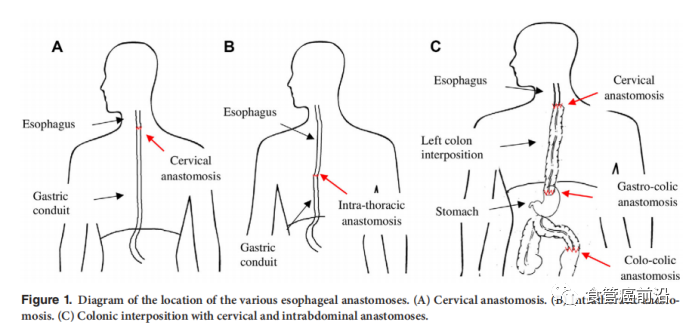
吻合的位置和类型是理解和处理吻合口瘘的重要因素。在食管切除术中,吻合可能位于三个不同的位置:颈部,胸腔或腹部。
对于颈部吻合术,胃穿过胸腔。这种吻合术比胸腔有更高的渗漏率。研究和系统评价显示,颈部吻合瘘的发生率为12–14%,而胸内吻合瘘的发生率为3–9.3%。这种较高的发生率是由于吻合口具有更大的张力,并且由于颈部运动而承受的压力更大。吻合通常在胃管的最末端进行,血管的末端则位于较远的位置。颈部吻合口瘘的诊断可以是临床的。手术引流管中出现的唾液和气体应引起怀疑瘘。即使颈吻合口漏的风险较高,其后果也不同。如果泄漏仅限于颈软组织,则不会出现纵隔炎,从而改善患者的预后。可以通过打开伤口来控制颈漏出。轻微的异常可以通过观察得到彻底治疗,包括伤口护理,延迟口服,肠胃外营养和抗生素。有些颈漏严重的患者可通过以下措施康复。如果瘘未控制住或出现胸内并发症,则需要更侵入性的办法。这会导致住院时间延长和更高的再手术率。
对于胸腔内吻合术,其愈合条件比在颈部吻合术中更有利,但瘘的后果更为严重。来自胸腔的负压环境倾向于通过吻合口促进带有厌氧菌的胃液外渗。这会污染胸膜和纵隔空间,从而影响胸腔内负压,损害呼吸功能并最终导致死亡。尽早识别是关键的一步。临床症状可表现为心动过速,发烧和胸腔积液。体征可能更加微妙,例如精神状态改变,呼吸急促或心律不齐。单侧胸腔积液的发展应被怀疑是吻合口瘘,除非有其他证明。迅速调查的最低门槛是强制性的。吻合口瘘后患者的预后取决于污染程度。这与诊断的时间间隔直接相关。胸内瘘的处理措施应该个体化。保守无效的病人需要再次手术。
使用胃以外的间置器官(通常是结肠)会增加手术的复杂性。结肠是食道的合适器官替代物,可用于重建食管。为了确保足够的结肠间置长度,必须进行细致的血管解剖。移植物的血管通常取决于一个末端动脉分支,因此对其造成的损伤将导致移植物坏死。报道的结肠坏死或局部缺血的发生率约为5%,而吻合口瘘发生率为12–14%。为了检测渗漏,通常经口服用造影剂进行胸腹计算机断层扫描(CT)扫描是首选诊断检查。
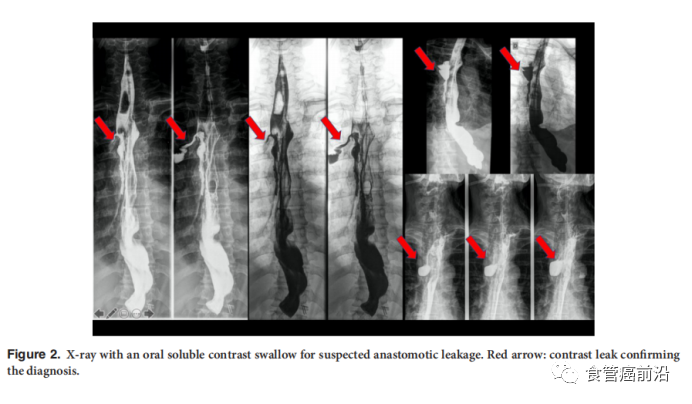
内镜检查也是可疑吻合口瘘初步评估的一部分。它可以对吻合口和胃管的血管形成进行视觉评估。在无症状患者手术后第6至第8天,可以通过X射线下口服可溶性对比剂检查吻合情况。在术后早期,由于多种因素(例如,机械通气和吞咽困难),有时可能无法进行口服造影剂的CT扫描,这时可以选用胃镜。几项研究证明食管切除术在1周内进行内窥镜检查对于吻合术是安全的。
吻合口瘘的管理有几个目标:缺损的封闭或覆盖,渗漏的遏制以及污染空间的引流。处理应与泄漏量相匹配。如果在术后72 h内发生瘘,则考虑是技术原因。如果患者的身体状况可以接受的,则进行手术探查和修复是适当的。然而,大多数渗漏发生在手术后2周,并呈现出炎症状态,不适合直接修复。对于小瘘,应引流感染部位(胸腔或颈部伤口),并延迟进食和使用广谱抗生素。足够的营养状况和局限性瘘,预示成功控制。若是大瘘或控制失败,则需要进一步处理。
内窥镜治疗吻合口瘘
内镜下直接封闭瘘口(放置夹子、缝合或喷胶)。也可以使用支架和真空治疗。直接封闭是个好办法,局限性包括难以抓住缺陷的边缘,如果瘘口较大(大于3 cm)或不对称,则结果较差。
支架或真空疗法患者的临床状况也应保持稳定,并且应将瘘口周围的引流干净。局限性在于潜在的支架迁移以及需要定期更换真空疗法。Dasari等[30]回顾了27个病例系列,其中340例患者接受了金属或塑料自扩张支架治疗。内窥镜置入支架治疗吻合口瘘的成功率为91.4%,架类型无差异。支架约需要放置6 – 8 周。支架总体迁移率为20.8%。与支架相关的并发症(出血和穿孔)发生在3%的病例中,所有患者的死亡率为13%。食管吻合口瘘的支架对于少于吻合口周长的30%且无广泛坏死的渗漏可能是有益的。大面积坏死或大瘘不适合支架。支架放置应在初始诊断期间进行。需要用胸部X射线照相术进行连续监视以监视支架的移动。Dai等在他们的研究中报告了35%的患者发生支架移位。
自扩张式金属支架(SEMS)应该用于积极的非手术治疗,并且在制定治疗计划时应予以考虑。Plum等研究了Ivor Lewis食管切除术后吻合口瘘的病例。在这种方法中,吻合是胸腔内的,并且泄漏对呼吸功能具有重大的有害潜力。在该亚组患者中,作者报告的密封成功率为70%(n = 49)。
支架拆除的时机很关键:不要太晚以避免支架相关的并发症。Freeman等观察了45例经支架置入的吻合口瘘患者(Ivor Lewis手术)。结果表明,当患者移除食道支架时,14天内移除预示支架相关并发症较少。这与早期取出支架的患者持续渗漏无关。他们得出结论,可以在放置支架后14天之内将其移除,而不会增加再次发生渗漏的风险
内窥镜腔内真空治疗是最近开发的治疗选择。 Loske于2007年描述了腔内真空的首次应用,用于上消化道手术后的吻合口漏,并显示出令人鼓舞的结果。负压促进了血管生成,去除了积聚的分泌物并减少了伤口腔的大小。自2010年以来,它已用于食道吻合口瘘。
治疗方法是在内窥镜引导下将海绵直接插入缺损区域。然后将引流管的末端连接到电子泵,该电子泵会产生负压。对于何时需要更换海绵系统,仍然缺乏证据。接受的时间范围为3到6天。在一些大中心,海绵系统每2至4天更新一次。其他研究报告平均治疗时间为11–27天,海绵交换率为2.75–6次。Schniewind等人数据表明,内镜治疗对危重患者的死亡率较低。他们比较了吻合口瘘的不同疗法(手术,内窥镜腔内真空,内窥镜支架和保守治疗),发现腔内真空组的院内死亡率最低。一项回顾性研究比较了自扩张金属支架(n = 76)和内窥镜真空疗法(n = 35)的结果。他们发现两组的成功率相当(支架组为85.7%,真空组为72.4%,P = 0.152)。中位ICU和住院时间相似。Scognamiglio等人最近发表的荟萃分析显示,与自扩张金属支架相比,内窥镜真空疗法在食管瘘愈合方面的成功率明显更高,治疗时间更短,住院死亡率更低。住院时间没有差异。治疗的类型似乎并不影响主要或短期并发症的发生率。然而,由于基础数据的局限性,没有明确推荐的治疗方法。
外科治疗
手术再干预的适应症取决于多个方面:
当出现败血症的征兆时,患者身体条件。
初始治疗失败后。
早期瘘(术后72小时内)。
控制不住的胸腔内吻合口瘘。
手术干预的选择包括:如果瘘很小并且没有广泛的污染,则可以对吻合口进行直接修复。外面用胸壁肌肉、网膜、胸膜或心包等覆盖。如果瘘口很大或管胃坏死,在这种恶劣的环境中很少有可能发生修复成功。可以考虑食管旷置和胃造瘘,如果患者存活,可以在第二次手术重建消化道。在这两种方法中,都需要进行空肠喂养,因为这些患者的口服喂养会延迟。这将提供肠内营养,从而改善胃肠道功能的恢复,防止细菌移位,并降低并发症的发生率。2005年,一项回顾性研究表明,针对瘘再次手术的死亡率不高于无吻合口瘘的死亡率。。他们报告了3.3%与死亡率相关的瘘。即使短期死亡率是可比的,吻合口瘘患者的5年生存率也降低了。K o f e d等发现,有瘘的患者的5年生存率是23%,没有瘘的患者的5年生存率是36%。
持续脓毒症患者再次手术的决定被延迟可能会导致致命的后果。这种无法挽救持续脓毒症的患者首先在结直肠手术中表现出来。尽管手术并发症的发生率相似,但高死亡率医院和低死亡率医院之间在术后并发症处理后的预后仍存在差异。在上消化道癌症手术中,英国已有相关研究。总体死亡率较低的单位比总体死亡率较高的单位更频繁地进行干预,并随后获得更大的成功。更加积极和适当的再干预似乎可以带来更好的结果。
译者点评:对吻合口瘘的防治,各家中心经验不同。上面这篇国外文献只是提出来一个大致原则,其实每项技术都需要经验和技巧。临床实践中,还需要每位医生根据患者的具体情况来诊治。
中国医学科学院肿瘤医院胸外科 秦建军 王镇 李印
原文链接:http://www.xxwk.net/archives/1037





